
自查核查最新進(jìn)度:現(xiàn)場核查目錄中已有5產(chǎn)品獲批!
發(fā)布時間:2016-10-25 來源:佚名
10月22日,藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃第7號發(fā)布。不到7個月的時間,從2016年3月30日的第1號,到2016年10月22日的第7號,7批核查計劃共涉及185個受理號。
筆者將這7批185個品種對應(yīng)第一批自查品種(2015年7月22日公告,1622個)、第二批自查品種(2016年4月1日公告,181個)以及第三批自查品種(2016年9月1日公告,82個)進(jìn)行深度分析。
近3個月第一批自查再無廠家撤回
2015年7月22日,CFDA發(fā)布的《關(guān)于開展藥物臨床試驗數(shù)據(jù)自查核查工作的公告》要求申請人對申請上市和進(jìn)口的1622個注冊申請,即“第一批自查”的臨床試驗數(shù)據(jù)真實性、完整性、規(guī)范性進(jìn)行自查。
對于第一批自查的1622個品種,扣除免臨床試驗的193個,需要進(jìn)行自查的品種共計1429個。根據(jù)“食品藥品監(jiān)管總局藥化注冊司負(fù)責(zé)人談新藥臨床數(shù)據(jù)核查”的數(shù)據(jù),截至2016年6月底,企業(yè)經(jīng)自查主動申請撤回了1193個,占應(yīng)自查總數(shù)的83%。
對比CFDA歷史公告,咸達(dá)數(shù)據(jù)V3.2發(fā)現(xiàn),2015年8月28日第169號公告中主動撤回的注冊申請317個;截至最近一次公告撤回的2016年3月1日第45號公告,企業(yè)主動撤回注冊申請累計876個,正好1193個,與6月底的撤回數(shù)量一致。這表示自最后一次自查撤回公告以來連續(xù)3個月沒有藥品主動撤回。
這意味著企業(yè)的撤回基本已經(jīng)定局,于是3月30日起CFDA食品藥品審核查驗中心開展藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃。
現(xiàn)場核查不批準(zhǔn)率或高于34%
按“食品藥品監(jiān)管總局藥化注冊司負(fù)責(zé)人談新藥臨床數(shù)據(jù)核查”,實際上自2015年10月起,CFDA已開展核查,但并未建立核查前公布計劃的制度(2016年3月前未公布過現(xiàn)場核查計劃)。截至2016年9月底,CFDA共核查117個注冊申請。
CFDA在2016年9月底以前對其中存在真實性問題的30個作出了不予批準(zhǔn)的決定,約占應(yīng)自查核查品種的2%;對涉嫌數(shù)據(jù)造假的27個品種11個臨床試驗機(jī)構(gòu)和合同研究組織(CRO)予以立案調(diào)查。
那么,經(jīng)過CFDA食品藥品審核查驗中心的藥物臨床試驗數(shù)據(jù)現(xiàn)場核查后藥品的不批準(zhǔn)率到底有多高呢?
鑒于2016年藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第6號)的公告期為2016年9月14日至2016年9月28日,這表示2016年9月底的核查應(yīng)該是完成前5號現(xiàn)場核查計劃公告的品種,亦即81個受理號。
咸達(dá)數(shù)據(jù)V3.2發(fā)現(xiàn),2016年CFDA唯一一次公布的藥品注冊申請不予批準(zhǔn)公告(2016年第92號“總局關(guān)于7家企業(yè)6個藥品注冊申請不予批準(zhǔn)的公告”)中,沒有一個受理號來自這81個受理號,而該公告公布的日期為4月29日,這表示所有不予批準(zhǔn)的核查都在食品藥品審核查驗中心的藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃第一次公告發(fā)布前已完成(第2號發(fā)布日期為5月4日))。
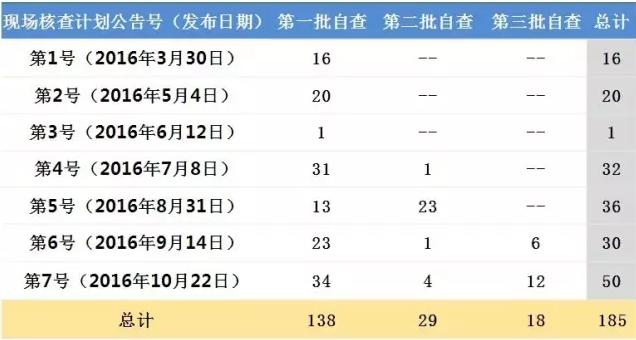
此外,藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃的7次公告,每一次都有來自源于第一批自查的受理號,目前共涉及138個第一批自查的受理號,占第一批自查的8.5%。這意味著第一批自查的臨床試驗數(shù)據(jù)現(xiàn)場核查仍在進(jìn)行。
第一批自查總共1622個受理號數(shù),扣除臨床試驗的193個,再扣除企業(yè)經(jīng)自查主動申請撤回的1193個,以及扣除2015年8月28日由于未提交自查資料也未主動撤回導(dǎo)致注冊申請不予批準(zhǔn)的受理號10個,預(yù)計最多226個產(chǎn)品面臨臨床核查。這226個品種中,再扣除138個進(jìn)入藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告第一批自查的受理號,剩下的受理號數(shù)即為現(xiàn)場核查計劃公布制度未建立前接受現(xiàn)場核查的最大可能受理號數(shù)。將不批準(zhǔn)的30個受理號數(shù)除以未建立前接受現(xiàn)場核查的最大可能受理號數(shù),即可初步估計經(jīng)過CFDA的現(xiàn)場核查后最終不予獲批的比例,該比例不低于34%。
第二批、三批自查品種已啟動現(xiàn)場核查
目前CFDA食品藥品審核查驗中心已公布7批藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃,共涉及185個受理號。
2016年,CFDA分別在4月1日和9月1日公告需要進(jìn)行臨床試驗數(shù)據(jù)自查核查的注冊申請181個“第二批自查”受理號和82個“第三批自查”受理號。
自第4號藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃起,都有來自于第二批自查受理號,目前共覆蓋29個受理號,占第二批自查受理號數(shù)的15.9%。自第6號藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃起,亦有第三批自查受理號出現(xiàn),共18個受理號,占第二批自查受理號數(shù)的22.0%。
表1:現(xiàn)場核查計劃對應(yīng)的自查批次受理號情況
第1號、第2號現(xiàn)場核查目錄已有產(chǎn)品獲批
在現(xiàn)有7批現(xiàn)場核查的185個受理號中,53%是進(jìn)口廠家的申報品種,然而暫無進(jìn)口廠家產(chǎn)品獲批。
2016年9月獲批的中藥和生物制品的新藥都來自藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃,現(xiàn)場核查計劃公告(第1號)獲得注冊批號(新藥證書)的比例為12.5%,現(xiàn)場核查計劃公告(第2號)獲批比例為15%。
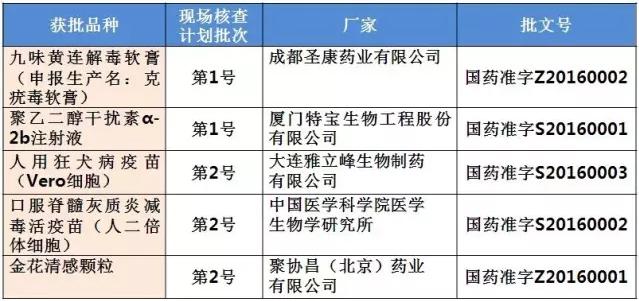
185個受理號最早的申報年可以追隨到2005年,2006年和2007年的申報也各有1個。其中屬于第一批自查名單的2006年成都圣康藥業(yè)有限公司申報生產(chǎn)的克疣毒軟膏在藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第1號)中,并屬于2016年CFDA公布的9月獲批的藥品批準(zhǔn)文號名單,獲批藥品名為九味黃連解毒軟膏(國藥準(zhǔn)字Z20160002)。
2006年申報生產(chǎn)的中藥6類新藥,經(jīng)過10年臨床核查還能過,這意味著歷史久遠(yuǎn)的項目也是有可能獲批。
同屬于第一批自查名單和藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第1號)中的廈門特寶生物工程股份有限公司的聚乙二醇干擾素α-2b注射液(國藥準(zhǔn)字S20160001)亦在9月獲批。
藥物臨床試驗數(shù)據(jù)現(xiàn)場核查計劃公告(第2號)中的第一批自查也有受理號同樣也是在2016年9月獲批,為大連雅立峰生物制藥有限公司的人用狂犬病疫苗(Vero細(xì)胞)(國藥準(zhǔn)字S20160003)、中國醫(yī)學(xué)科學(xué)院醫(yī)學(xué)生物學(xué)研究所的口服脊髓灰質(zhì)炎減毒活疫苗(人二倍體細(xì)胞)(國藥準(zhǔn)字S20160002)和聚協(xié)昌(北京)藥業(yè)有限公司的金花清感顆粒(國藥準(zhǔn)字Z20160001)。
表2:現(xiàn)場核查目錄中已獲批產(chǎn)品
結(jié)論>>>
2016年前三季度CFDA公布的新獲批藥品注冊批文以化學(xué)藥品原料藥和注射劑為主,化藥口服大多數(shù)還未開始審批。
一般而言,能夠堅挺到等待CFDA的現(xiàn)場核查而不撤回的廠家通常對自己的項目較有信心,亦即市場和項目質(zhì)量較好的項目。
9月中藥和生物制品的新藥獲批,意味著藥物臨床試驗數(shù)據(jù)現(xiàn)場核查的結(jié)論會逐步公開,并且大量好產(chǎn)品有望獲批。





